微生物组疗法在过去短短半年内已经迎来了两款上市药物,也是两个行业的重要里程碑。
去年11月,FDA批准Rebiotix公司的粪便微生物组疗法Rebyota(RBX2660)上市。这是FDA批准的首款微生物组疗法。今年4月底,美国FDA宣布,批准Seres Therapeutics公司口服微生物组疗法Vowst(SER-109)上市。这是FDA批准的首款口服粪便微生物组疗法给整个微生物组疗法赛道再度注入信心。
Seres一直是微生物组药物的主要开发商之一。这家生物技术公司由Flagship Pioneering在10多年前创立,是该赛道第一家上市公司。自2015年IPO以来,该公司一直试图将一种微生物药物推向市场,但是走的并不顺利,2016年后调整了试验计划,如今终于等到了产品获批的好消息。
紧追Seres ,包括Finch和Vedanta Biosciences公司在内的其他公司也在开发针对炎症性肠病的微生物组药物。
近期Vedanta Biosciences公司完成了1.065亿美元的E轮融资。本轮资金将用于2款在研药物的临床试验。一个是预防复发性艰难梭菌感染(CDI)的VE303,即将进入3期关键阶段试验。另一个是治疗溃疡性结肠炎的VE202,即将进入2期临床试验。此次投资来自18位投资者,其中包含新投资者AXA IM Alts和The AMR Action Fund,以及现有投资者比尔及梅琳达•盖茨基金会、Skyviews Life Science、联合创始人PureTech Health、辉瑞公司等。
人体是一个生态系统,有数以万亿的微生物与我们的身体共存。它们组成人体微生物组,通过调节免疫系统和传染病抵抗力来保护人体健康。人体微生物组的改变越来越被认为是免疫和传染病发展的关键因素。
Vedanta Biosciences是一家旨在治疗免疫介导和传染病的免疫疗法开发商。该公司利用微生物生态学、粘膜免疫学等技术原理,设计基于人类共生细菌菌群治疗疾病的药物和疗法。其突破性研究史要追溯到1985年。
1985年,Dan Littman开启了分子CD4和CD8的鉴定和克隆。这些分子对免疫识别和反应至关重要。Dan Littman是美国国家科学院、美国国家医学科学院和美国艺术与科学院、美国免疫学家协会前任主席,并获得了罗斯分子医学奖和维尔切克生物医学科学奖。他还担任辉瑞制药公司的董事会成员。
1997年,Ruslan Medzhitov发现了人类Toll样受体在感知微生物感染中的作用,为先天免疫领域奠定了基础。他发现了首个哺乳动物Toll受体,并展示了先天免疫识别在控制适应性免疫反应中的重要作用,这是现代免疫学的基本范式之一。2004年,Ruslan Medzhitov证明微生物群通过TLR信号传导影响肠道免疫稳态。这确定了微生物群可以调节肠道炎症。他目前是耶鲁大学医学院的斯特林教授和霍华德•休斯医学研究所的研究员,国家科学院和国家医学院的成员。
Alexander Rudensky的实验室证明了转录因子FOXP3作为Treg细胞谱系规范因子的作用。他的研究为调节性T细胞在免疫耐受和各种病理过程中的基本作用提供了重要的见解。Alexander Rudensky目前是免疫学项目主席和纪念斯隆-凯特林癌症中心(MSKCC)、路德维希癌症免疫治疗中心主任,霍华德•休斯医学研究所的调查员,以及MSKCC、洛克菲勒大学和康奈尔大学的三机构教授。
BRETT FINLAY是霍华德•休斯医学研究所的调查员,也是不列颠哥伦比亚大学的教授,主要研究分子水平上的宿主-病原体相互作用,发表了500多篇论文。因其工作而受到国际认可,他被任命为加拿大皇家学会和加拿大健康科学院院士、加拿大官员,并被授予不列颠哥伦比亚省勋章。他还是SARS加速疫苗倡议的主任。
Kenya Honda是Vedanta多项独家专利技术的主要发明人,其研究重点在于肠道微生物群的免疫学属性,并试图识别微生物群的相关功能组成及其衍生因素。他是日本东京庆应义塾大学医学院微生物学和免疫学系教授,横滨市立肯综合医学科学中心(IMS)肠道稳态实验室的团队负责人。他于2014年获得戈特弗里德·瓦格纳奖,并于2016年获得贝尔茨奖。

Vedanta Biosciences联合创始人
图源:Vedanta Biosciences
2010年,Dan Littman和Kenya Honda研究表明,人类相关细菌可以诱导肠道Th17细胞。这启示了可以通过操纵微生物组来治疗自身免疫性疾病。同年,在生物科技公司PureTech Health的支持下,联合创始人Bernat Olle博士(现任CEO)与5位科学联合创始人一同创办了Vedanta Biosciences。
目前,Vedanta Biosciences已经鉴定出多种可诱导不同免疫反应的人类共生细菌,包括诱导调节性T细胞、CD8+T细胞和Th17细胞等。这些成果已发表于在Science、Nature、Cell和Nature Immunology等顶尖期刊。
科学创始人持续多年的研究作为最好的科学基础,为Vedanta Biosciences建立了扎实的理论基础和稳健的发展势头。变革性的分离克隆方法和细菌菌群设计则是其核心所在。
Vedanta Biosciences所研发的微生物菌群疗法基于菌群的克隆制作。微生物菌群制作首先需要将特定细菌菌群从人类标本中分离,进入Vedanta的菌株库,再通过克隆培养出细菌菌株,随后发酵、冻干,混合成为确定的菌群,制成粉剂,最终以口服胶囊形式给药。
Vedanta搭建了一个专有发现平台,能够识别具有药物类特性的细菌菌株,并根据GMP标准进行制造。目前Vedanta已为数十种肠道细菌菌株建立了专有菌株库。
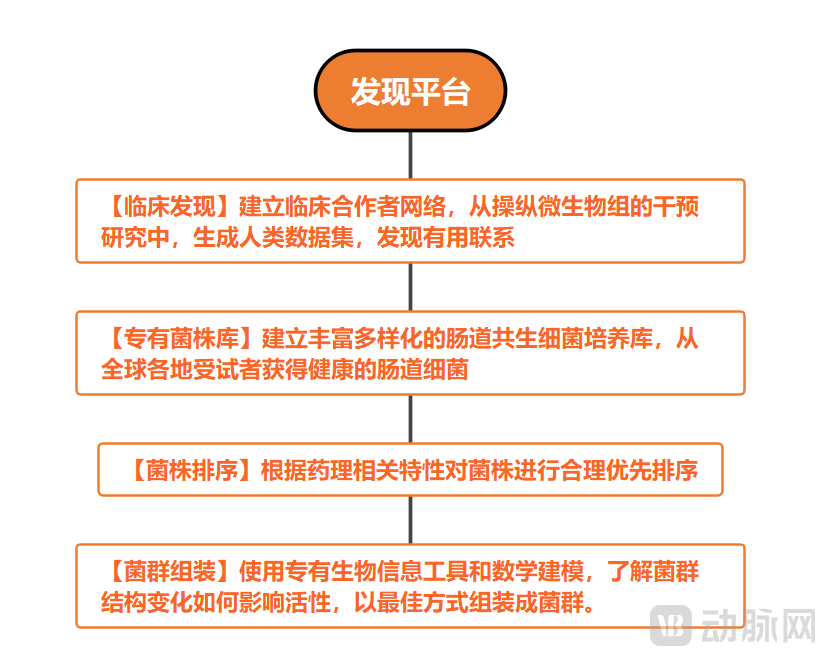
Vedanta Biosciences建立的菌株发现平台
内容:Vedanta Biosciences
制图:动脉网
以艰难梭菌感染(CDI)为例,传统粪便移植疗法需要捐赠者的生物标本。这些样本中可能带有衍生微生物或病原体,有感染其他疾病的风险。而克隆库的建立则不需要移植粪便供体材料,直接使用克隆分离的细菌菌群,消除了捐赠标本中病原体转移的风险。
其次,克隆和分离出的特定菌群将疗法的选择性大大提高,从传统的非靶向飞跃至靶向治疗。定制化的菌群决定了药品制造过程中能够精确调整和混合每种菌株,并确保其含有相同剂量和活性成分,消除了粪便移植供体中剂量和有效细菌成分因人而异的问题。
为达到这一精确定制效果,Vedanta 打造了一个大型CGMP(Current Good Manufacture Practices动态药品生产管理规范)制造平台。CGMP平台以其在微生物组领域的CMC专业知识为基础,能够实现高度可扩展和具有成本效益的特定细菌菌群生产,支持其管道的全球临床扩张。该制造平台使Vedanta拥有了从临床开发到商业生产全过程的CGMP能力。
药物中的有效细菌菌群进入人体,沿着胃肠道传播并定植于肠道。定植的菌群将改变肠道微生物群的组成,提供对一系列肠道感染性病原体的定植抗性,刺激靶向免疫反应,以达到改善肠道生态系统的目的。
基于这一免疫疗法,Vedanta首先开发了VE303管线。VE303主要用于治疗高风险的艰难梭菌感染(CDI),治疗方式为口服药物。VE303由8种类型的克隆人类共生细菌菌株组成。这些菌株因其具有对艰难梭菌的定植抗性而被选择。
艰难梭菌是一种可存在于正常肠道菌群中的细菌。但当大量应用广谱抗生素、免疫抑制剂或化疗药物后可能导致肠道菌群失调,艰难梭菌过度繁殖并分泌毒素,进而引发CDI。CDI主要临床症状为腹泻、腹痛、发热等,严重者可引发伪膜性肠炎,可伴中毒性巨结肠、肠穿孔、感染性休克等并发症,甚至导致死亡。
根据《中国艰难梭菌医院感染预防与控制指南》,近年来艰难梭菌已成为医疗机构内感染性腹泻最常见的病原体之一。CDI显著增加了患者的经济负担和病死率。美国疾病控制与预防中心2019年发布的抗菌药物耐药威胁报告中,将艰难梭菌列为对公共卫生健康威胁级别最高的“极危(Urgent)”等级,其警示级别高于“超级细菌”的“严重(Serious)”等级。
在随机、双盲的二期试验中,高复发风险患者在完成前CDI抗生素疗程后,使用VE303预防CDI复发。此次试验在八周内达到疗效关键终点,评估了VE303的安全性、耐受性、药代动力学/药效性和疗效。实验结果显示,其耐受性普遍良好。Vedanta计划于2023年启动VE303的三期临床试验。
CDI治疗之外,微生物菌群刺激免疫反应的治疗原理被扩展至更多自身免疫性疾病和炎症性疾病,包括在自身免疫和过敏性疾病方面的免疫调节反应、在癌症和疫苗接种方面的免疫增强反应。
目前该公司在研药物5种,其中免疫肿瘤学药物VE800与百时美施贵宝公司签订了临床实验合作协议,在首次入院临床试验中与其检查点抑制剂OPDIVO联合评估。VE800由11种克隆的人类共生菌菌株组成。这些菌株因其能够诱导CD8+ T细胞、增强免疫系统对肿瘤的攻击、增强检查点抑制剂的作用而被选择。
Vedanta还两次获得了CARB-X共计1120万美元的资助。资金用于VE303临床测试和VE707的加速开发。VE707用于预防多种多重耐药感染菌(MDRO)的感染定植和复发,包括最常见的一些医院获得性感染——耐碳青霉烯肠杆菌科 (CRE)、超广谱 β 内酰胺酶生产菌 (ESBL) 和耐万古霉素肠球菌 (VRE)的肠道携带。这些医院获得性感染可能导致患者的治疗延迟或死亡,具有大量未满足的治疗需求。
VE202是治疗炎症性肠病(IBD)的口服药物,菌株因其能够影响肠道粘膜中调节性T细胞的数量和活性而被选中。一期研究数据显示,VE202在所有剂量下总体安全且耐受性良好,表现出持久和剂量依赖性的定植。该药物将在本轮资金支持下开始二期研究。
VE416是用于治疗食物过敏的药物。在临床前研究中,VE416刺激了保护性免疫调节反应,并减少了过敏性小鼠的过敏和过敏症状。该药物于2019年开始了1/2其临床研究,试验数据预计在2023年公布。
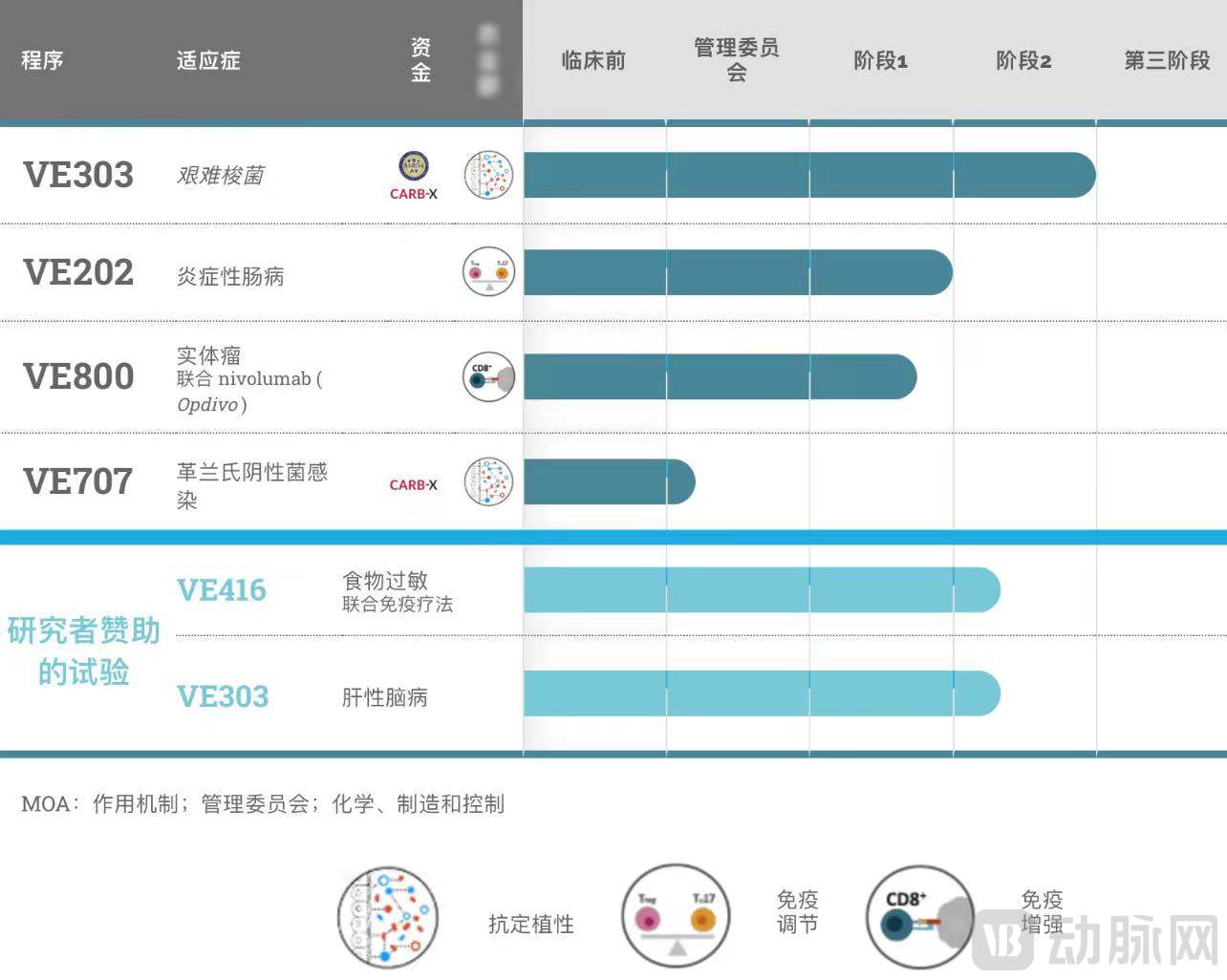
Vedanta Biosciences管线设置
图源:Vedanta Biosciences官网
在微生物菌群赛道上,CDI广泛的治疗需求带来了药物研发的蓝海市场。
去年11月,FDA批准的首个粪便微生物药物Rebyota是一种单剂量灌肠剂,由供体粪便中提取的肠道细菌样本制成。今年4月底FDA批准首款口服微生物菌群药物Vowst用于治疗 18 岁及以上成人患者的复发性艰难梭菌感染。这款药物中的活体人类肠道菌群同样来自于捐赠供体,经过筛选、纯化、加工成为口服式胶囊。
上述两个药物所含的活体细菌均源自合格供体捐赠的粪便。尽管生产过程中已进行了一系列可传播病原体的检测,但FDA表示药物仍然存在传播传染原的风险,同时可能发生食物过敏原引起的不良反应。而Vedanta的分离克隆方式,不直接采用供体细菌,根本上消除了病原体转移的风险,为活体微生物药物带来了新的可能。
微生物菌群药物已走入临床治疗,纯克隆制造的微生物菌群药也已在路上。从人体微生物组出发,通过药物重新回归人体生态,微生物疗法还将带来什么惊喜,我们翘首以待。
2017年,中国科学院启动了人类微生物组计划,新一轮微生物组技术研究和开发进入了研究热潮,微生态疗法进入快速发展阶段,国内同样涌现出了像未知君生物、慕恩生物、知易生物、奕景生物等微生物组研发公司。








 提供支持
提供支持




















