在最近半年中,由生成式AI(人工智能)引领的新一波AI热潮的热度居高不下。仍处于发展初期的生成式AI自身的确具有颠覆行业的巨大潜力,但我们也不应该忽视AI与应用场景的成功落地也为生成式AI热潮起到了“背书”的作用。仅仅以医疗场景而言,医疗AI在过去十年中取得了超乎想象的发展,并切实起到了为医疗赋能的巨大作用。
美国是全球医疗新科技应用最积极的国家之一,同时也是全球AI产业的领头羊。作为医疗行业的监管机构,FDA对于医疗AI一直秉承积极的态度,早在1995年就审批通过了首款AI医疗器械。截至2022年底,FDA已累计批准了521款AI医疗器械,使美国成为了全球AI医疗器械获批最多的国家和地区。
他山之石,可以攻玉,动脉网(微信号:VCBeat)对FDA批准的500多款AI医疗器械进行了分析总结,希望能够对行业发展提供参考。
在FDA的分类中,将具有AI赋能的医疗器械称为“AI/ML-Enabled Medical Devices”,即具有人工智能和深度学习的医疗器械。这里,有几个容易混淆的概念需要厘清。
首先是AI的内涵。伴随着技术的不断进展,AI的内涵一直在不断发展变化。目前,AI所采用的技术包括基于数据统计分析的模型、主要依赖于“if-then”语句的专家系统及ML(机器学习,Machine Learning)等。
这其中,近年来被频繁提及的ML是AI概念下的一个子集,指应用机器学习设计和训练的算法可从数据中学习并采取行动。开发人员可以利用机器学习来创建功能“固化”的算法;与之相对的则是“自适应”算法,其行为可以根据数据的更新或伴随时间推移发生改变。
根据不同的学习方法,机器学习算法又可以分为监督学习(如分类问题)、无监督学习(如聚类问题)、半监督学习、集成学习、深度学习和强化学习。这其中,利用模仿人类大脑网络的深度神经卷积网络并实现学习的深度学习在最近十多年来获得了突飞猛进的发展并被广泛应用,几乎快要成为机器学习乃至AI的代名词。
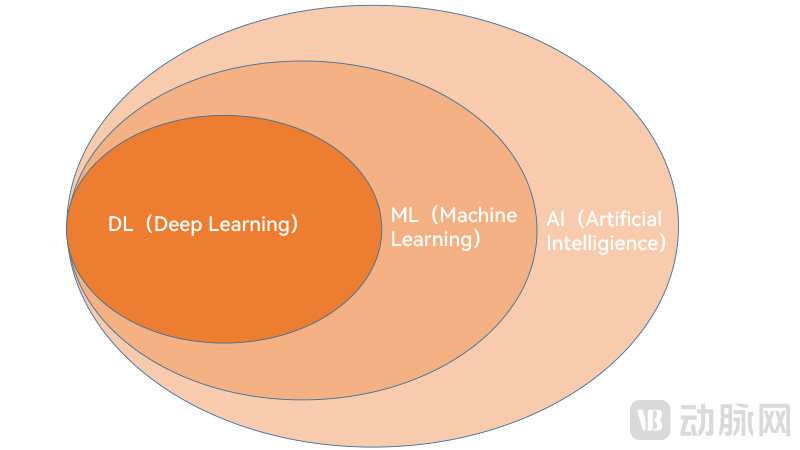
DL、ML和AI的关系(动脉网制图)
FDA对此的定义并非独创,而是来自各国医疗行业监管部门组成的IMDRF(国际医疗器械监管论坛)协商达成的结果。因此,这一体系同样也被我国所采用,并基于此发布了相应的监管框架。
FDA很早就审批通过了AI医疗器械——根据FDA公布在其官网的统计,1995年11月,Neuromedical Systems的Papnet测试系统就成为了FDA批准的首款AI辅助医疗器械。
这款设备早已退市。根据互联网上遗留下来的资料,这款适用于病理科的器械可以利用AI辅助分析宫颈涂片影像,并将其判断出来的异常细胞图像显示在显示器上,交由专家进行检查。不难看出,这是一款典型的AI病理器械。
毕竟是第一款AI医疗器械,这款设备被FDA谨慎地划分为3类医疗器械,需要完成严格的临床试验与实验室测试,通过严格的PMA(上市前批准申请)路径获批。
不过,此后十多年时间其实并没有几款AI医疗器械获得FDA的批准。一直到2010年,FDA批准的AI医疗器械才突破10款。
就在两年后的2012年,如今大红大紫的深度学习迎来了里程碑——神经网络之父Geoffrey Hinton带领课题组构建的CNN卷积神经网络AlexNet首次参加ImageNet图像识别比赛,以碾压第二名(SVM方法)的分类性能获得冠军,引发了行业对深度学习的高度关注。此后几年,深度学习不断得到完善,并在实际应用场景中落地。
从彼时起,FDA审批的AI医疗器械数量开始快速持续增长。井喷的申请让FDA逐渐意识到,传统的医疗器械审批流程难以适用于人工智能医疗器械。由此,FDA出台了一系列文件和指南,指导医疗器械的监管改革与创新。
2017年7月,FDA下属的CDRH(医疗器械和放射健康中心)发布了数字健康创新行动计划(Digital Health Innovation Action Plan),对医疗软件提出监管方法的新举措。希望通过该计划的发布以促进电子健康产品的不断创新。
随后,FDA启动了医疗器械独立软件预认证试点项目(Pre-Cert for Software Pilot Program)。这个FDA数字健康创新行动计划的重要内容在我们以往的文章中已多次介绍,旨在通过考虑软件产品的特点建立新的、更具实效性的监管方法。
2019年6月,FDA又发布《基于AI/ML的SaMD进行修改的拟议监管框架》,将SaMD(软件医疗器械)的生命周期分为产品生产、产品注册与产品上市后三大周期,希望提出一种符合人工智能医疗器械生命周期的监管框架。
作为该框架的成果,FDA又在2021年发布了其第一个专门针对AI/ML赋能SaMD的行动计划,划提出了五项行动计划方法,以促进FDA对基于AI/ML SaMD的监督。
从后来的走向及实际的审批情况来看,这一系列措施的确极大地推动了AI医疗器械在美国的审批。
根据官方统计,截至2022年底,FDA已经审批通过了521款AI医疗器械。这些器械的涵盖范围广泛,不仅包含我们常说的以人工智能辅助诊断软件为代表的SaMD,也包含了不少内置AI功能的硬件设备,如CT、MRI乃至电子听诊器。
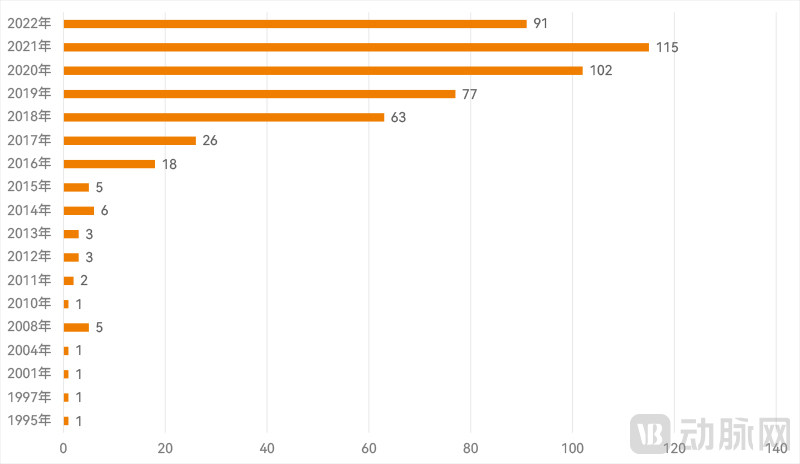
历年FDA批准AI医疗器械按时间分布(动脉网制图)
按获批时间来看,这些器械大部分是在近五年内获批。从1995年到2015年长达二十年的时间里,每年获批的AI医疗器械都仅有个位数,或者干脆没有。
2016年是第一个分水岭,当年获批的产品数量首次达到了两位数。2018年则是另一个分水岭,当年获批的产品数量一举达到63款,比前一年26款的数量大幅增加了2.4倍。2021年,FDA批准AI医疗器械的数量达到115款的峰值。
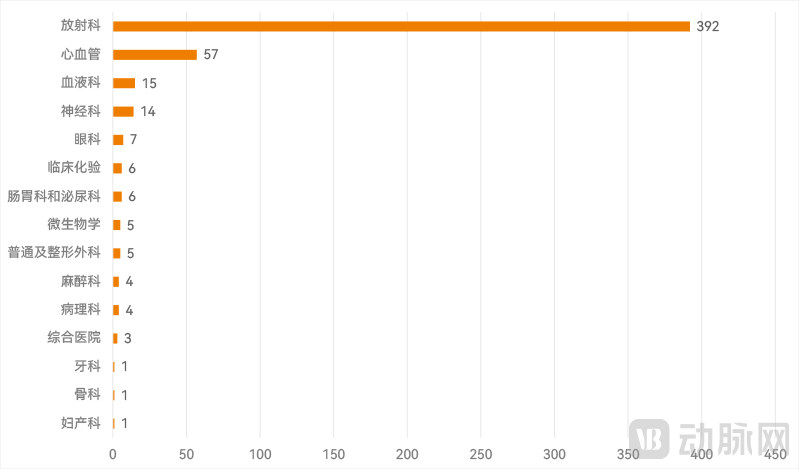
历年FDA批准AI医疗器械按应用方向分布(动脉网制图)
从应用领域来看,放射是绝对大类,共有392款用于放射领域,比重高达75.2%。其次是心血管方向,共有57款产品,占比为10.9%。仅上述两个方向的AI医疗器械就占到了总量的八成以上。
除此之外,FDA批准上市的AI医疗器械还涵盖了血液、神经、眼科、肠胃及泌尿、临床化验、微生物学、普通及整形外科、病理、麻醉、综合医院、骨科、妇产、口腔等方向。
除了放射领域基本为AI影像之外,其他应用方向也有不少产品实际上是AI影像医疗器械。因此,影像依然是医疗AI助力最为广泛的领域。
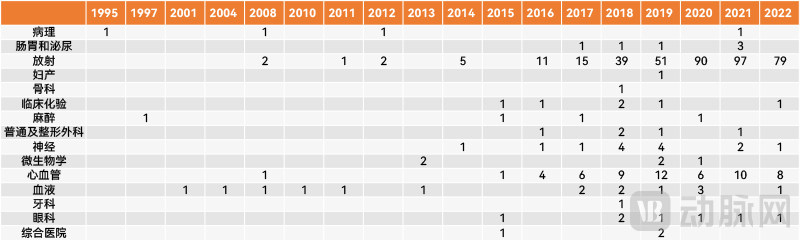
历年FDA批准AI医疗器械按时间及应用方向分布(动脉网制图)
如果将应用方向和时间结合来看,就不难发现,FDA批准AI医疗器械的高峰期正好也和AI影像的崛起高度重合。在AI医疗器械获批数量首次破十的2016年,放射方向的AI医疗器械就多达11款,占比超六成。随后几年,放射方向的AI医疗器械在全年占比的数量和比例都迅速增加,从六成左右的占比增加到超八成占比。
除了放射方向,同样的情况也适用于心血管方向的AI医疗器械。此外,如前所述,在其他应用方向上也有不少产品属于AI影像。
另外,我们也以“软件”为关键词对其中的SaMD进行筛选。历年共有148款AI SaMD的申请获批上市,且这些产品的获批数量及其在当年获批AI医疗器械中占比快速上升的时期与总量快速增长的时期重合。
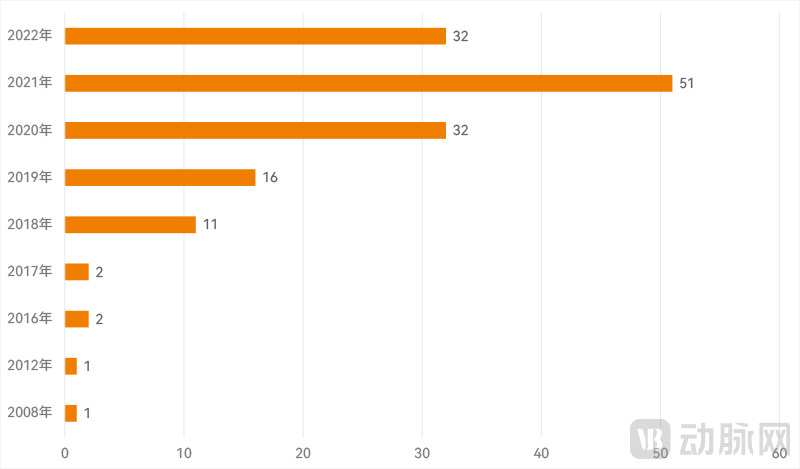
历年FDA批准AI软件医疗器械按时间分布(动脉网制图)
比如,SaMD同样也是从2016年开始快速增长;同时,2020、2021及2022是FDA批准AI医疗器械最多的三年,SaMD在其中的比例也达到新高,分别为31.4%、44.3%和35.2%。
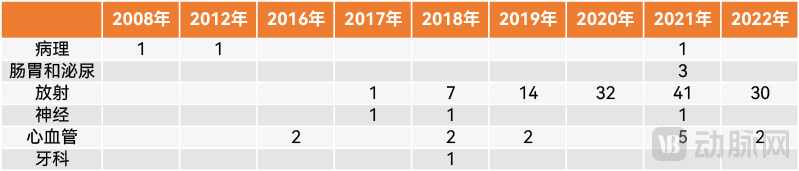
历年FDA批准AI软件医疗器械按时间及应用方向分布(动脉网制图)
由于这些SaMD多为AI影像产品,不夸张地说,正是AI影像的爆发带来了FDA批准AI医疗器械的高峰,或者,也可以说FDA的积极批准推动引爆了AI影像。
此外,约有80%的获批AI医疗器械以X光为主要的工作模式。所涉及的病变部位集中在头部、乳腺和胸部,其中,大约10%的设备可用于多个部位。
这些AI医疗器械基本被分级为2类医疗器械,以510(k)(上市前通知)路径获批,数量共有500款,占比高达96%之多。由于510(k)只需通过提交与市面已获批医疗器械的对比,证明申请器械至少与已上市产品同样安全或更安全,且不能引起有关安全及有效性的任何问题即可。因此,这一流程可以大幅提升获批效率。
除了510(k),历年共有18款AI医疗器械以De Novo方式申请上市。由于De Novo类似于我国的2类创新医疗器械,这也代表了这些AI医疗器械具有一定的创新性。这些通过De Novo获准上市的产品也为后来同类产品的快速上市铺平了道路。
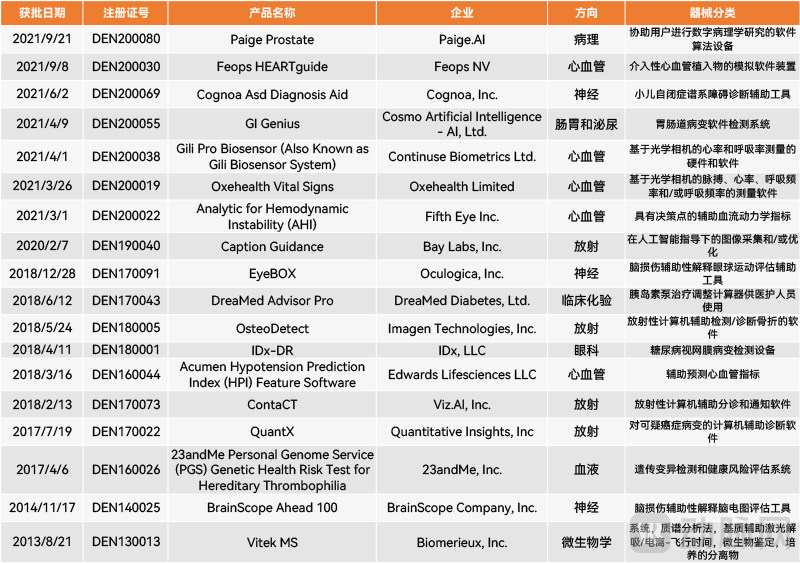
历年FDA以De Novo路径批准的AI医疗器械(动脉网制图)
历年仅仅只有3款AI医疗器械以PMA(上市前批准申请)路径获批上市,皆为AI影像类产品。一般而言,PMA路径代表了较高风险的3类医疗器械。

历年FDA以PMA路径批准的AI医疗器械(动脉网制图)
这其中较为特殊的是2016年获批的QVCAD System。其在审批时是以3类医疗器械的“分析仪、医学影像”获批。不过,2020年1月,FDA重新对AI辅助诊断乳腺癌(X光)、乳腺病变(超声)、肺结节(X光)和龋齿(X光)的医疗器械进行分类,将其重新分类为2类医疗器械。自那以后,在“分析仪、医学影像”门类下陆续又有5款AI医疗器械获批上市。当然,后续的申请路径变为了适用于2类医疗器械的510(k)。
近三十年时间,总计521款AI医疗器械,仅仅只有三款产品被分级为3类医疗器械。这多少有些出人意料,一方面说明FDA对于AI倾向于放松管控,鼓励发展;另一方面,FDA传统对于风险较高的容忍度或许也是原因之一。
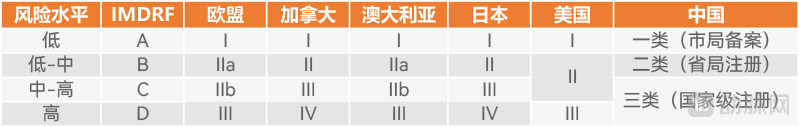
各国及地区医疗器械分类差异(动脉网制图)
最为典型的是在中-高风险等级医疗器械的分类上,FDA将中-高风险等级医疗器械划入2类医疗器械,仅需提交510(k)实质性等同申请;但出于医疗安全角度考虑,同样遵循三级分类方式的我国将中-高风险等级医疗器械划分为3类医疗器械,需要严格的临床试验。
以推想医疗的“颅内出血CT图像辅助分诊软件(InferRead CT Stroke.AI)”为例,FDA于2021年8月以510(k)方式批准该产品上市,分级为2类医疗器械;但在国内则以三类医疗器械管理,于2022年6月获准上市。

推想医疗的“颅内出血CT图像辅助分诊软件”在国内以三类医疗器械获批(截图自NMPA官网)

在FDA则以二类医疗器械获批(截图自FDA官网)
当然,这只是说明两国监管机构在AI医疗器械的监管上选择了更适合各自实际情况的监管策略,并没有优劣之分。
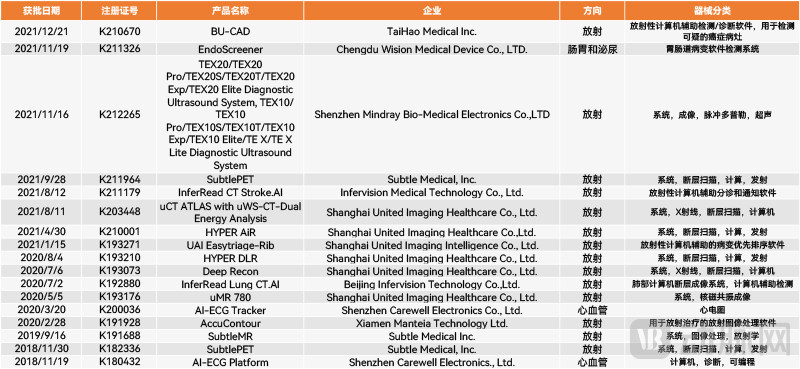
FDA通过的部分中国AI医疗器械(动脉网制图)
根据不完全统计,目前国内已有17款AI医疗器械获得了FDA的批准。它们分属联影医疗、深透医疗、乐普医疗、推想医疗、微识医疗、迈瑞医疗、Manteia数据科技和太豪生医。这其中,联影医疗共有6款医疗器械获批,深透医疗、推想医疗和乐普医疗也有多于一款AI医疗器械获批。
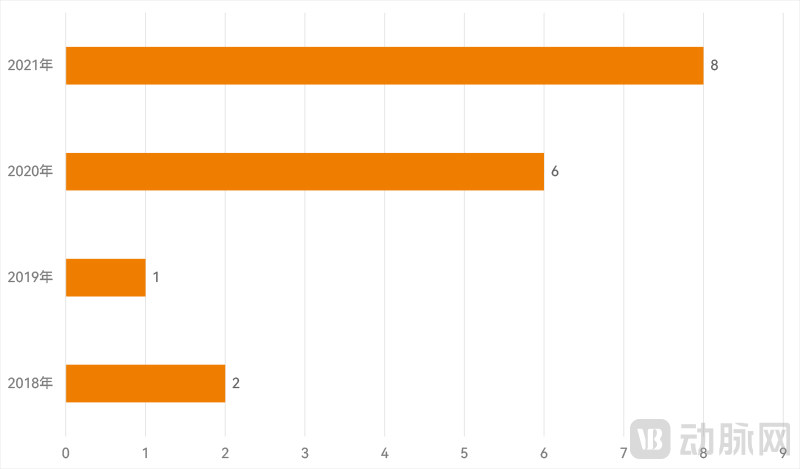
FDA通过的部分中国AI医疗器械按时间分布(动脉网制图)
从获批时间来看,这些医疗器械均为2018-2021年期间获批,其中,2021年和2020年是两个高峰,分别有7款和6款获批。这也说明近年来我国大力发展医疗器械产业,取得了长足进步。
医疗AI智能化医疗器械产品所属行业是一个强监管行业,产品安全有效性评价较谨慎。特别是以人工智能为代表的技术,本质上是基于海量数据驱动的黑盒算法,具有更新迭代快等特点,给监管带来诸多挑战。FDA很早就在这一领域开始探索,取得了令人瞩目的成绩。
相比之下,我国虽然起步较晚,但近年在人工智能技术领域取得了跨越式的进步,在监管领域同样也在迎头赶上。从2019年开始,国家药监局牵头陆续组成19个跨部门、跨领域、跨行业的工作组,加快推进人工智能科技成果在医疗器械领域的转化应用。
以此为契机,我国人工智能医疗器械技术审评指导文件迅速实现从无到有的突破,审评指导体系也在加速建设。目前,已有8项AI医疗器械方向的审评原则及审批要点已发布,尤其是《深度学习辅助决策医疗器械软件审评要点》和《人工智能医疗器械注册审查指导原则》基于深度学习技术特点,结合软件预期用途的使用场景和核心功能,重点关注关于软件的数据质量、控制算法、泛化能力和临床使用风险,有效促进了行业发展。
2022年,我国还主导了AI医疗器械领域的首个全球性标准——IEEE P2801“医学人工智能数据集质量管理”国际标准,首次提出了数据集生存周期的管理框架,填补了相关国际标准空白。
就在数日前,7月10日,国家药监局器审中心又发布了《影像超声人工智能软件(流程优化类功能)技术审评要点》《病理图像人工智能分析软件性能评价审评要点》《病理图像人工智能分析软件临床评价审评要点》和《血液病流式细胞学人工智能分析软件性能评价审评要点》,为这些领域AI医疗器械的监管提供了依据,进而推动行业的发展。
截至2023年3月,我国已有48个人工智能SaMD获批,数据类型覆盖多种影像、生理信息和体外诊断数据,产品类型则涵盖辅助诊断、辅助检测、辅助分诊与评估。同时,已有14个AI SaMD进入创新通道,包括CT影像、眼底彩照和消化内镜辅助诊断,以及手术计划辅助等。
依托这些探索积累的经验,在即将到来的生成式AI与医疗结合的大潮中,我国也有望站在全球的最前列。就在7月13日,我国公布了《生成式人工智能服务管理暂行办法》,将从2023年8月15日起开始施行。这也是全球最先对生成式AI进行监管的办法之一。动脉网也将持续关注相关领域,并带来第一手的报道。
参考资料:
《中国医药报》2023年5月25日05版:《人工智能医疗器械监管概况》
闫若瑜,《中国医药报》:《构建科学审评指导体系 促进真实世界数据研究 人工智能医疗器械创新合作平台成果显著》
Denaro TJ, Herriman JM, Shapira O. PAPNET Testing System. Technical update. Acta Cytol. 1997 Jan-Feb;41(1):65-73. doi: 10.1159/000332307. PMID: 9022728.
Geeta Joshi, Aditi Jain, Sabina Adhikari, Harshit Garg, Mukund Bhandari. FDA approved Artificial Intelligence and Machine Learning (AI/ML)-Enabled Medical Devices: An updated 2022 landscape. medRxiv 2022.12.07.22283216; doi: https://doi.org/10.1101/2022.12.07.22283216.