
# 热门搜索 #
基因修饰iPSCs衍生的间充质干细胞应用于肿瘤治疗取得突破进展
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持中南大学梁德生教授团队利用非病毒基因打靶策略,将抑瘤基因TRAIL定点整合入诱导多能干细胞(iPSCs)中,并在动物模型里证明了TRAIL整合的iPSCs衍生间充质干细胞(iMSCs)的抗肿瘤效果以及iMSCs作为治疗因子靶向递送载体的可行性。该研究成果于3月10日以“Site-Specific Integration of TRAIL in iPSC-Derived Mesenchymal Stem Cells for Targeted Cancer Therapy”为题在《Stem Cells Translational Medicine》杂志在线发表,论文第一作者是博士研究生王祖佳。
基于间充质干细胞(Mesenchymal stem/stromal cells, MSCs)对肿瘤微环境的趋向性和低免疫原性,成体组织来源MSCs和基因工程化MSCs成为递送抗癌基因/药物的靶向细胞载体广泛用于癌症治疗研究和临床试验。然而,成体/工程化MSCs的临床应用仍面临以下挑战:成体MSCs的异质性和有限扩增能力、病毒载体的潜在免疫反应、以及基因编辑的脱靶和插入突变风险等。
为解决这些难题,研究人员应用自主研发的单链切割人工核酸酶TALENickases和非病毒基因打靶载体将治疗基因TRAIL定点整合至人诱导多能干细胞(iPSCs),通过定向分化制备基因修饰的iMSCs用于抗癌研究。结果显示TRAIL-iMSCs在体外显著诱导A375(黑色素瘤)、A549(肺癌)、HepG2(肝癌)和MCF-7(乳腺癌)等细胞凋亡。静脉输注的TRAIL-iMSCs在A375或MCF-7异种移植荷瘤小鼠体内有明显的肿瘤趋向性,TRAIL激活凋亡信号通路显著抑制肿瘤生长,且无明显副作用。
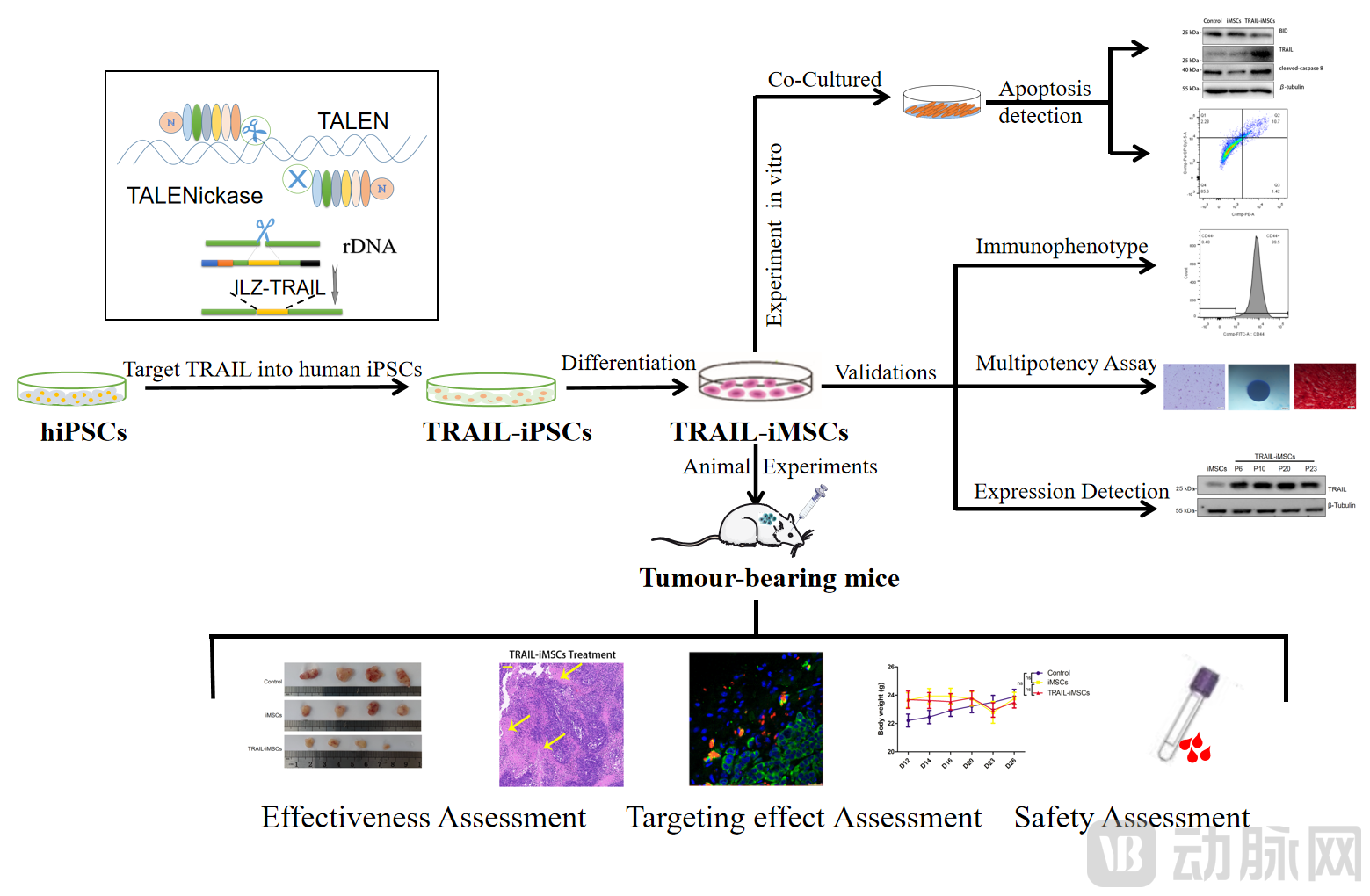
本研究首次在细胞和动物水平证明TRAIL定点整合iPSC衍生iMSCs的广谱抗癌效应,既可为病人个体化需求提供来源无限、均一性高和相对可控的治疗细胞,也可作为通用治疗细胞制剂实现产业化制备,具有很好的临床应用和产业转化前景。研究团队下一步将聚焦“多基因”定点整合策略,充分利用原创性的多基因安全打靶位点(Safe Harbor)的优势,构建多种治疗因子组合的“超能治疗细胞”,克服单因子治疗难以解决的肿瘤和自身免疫病等复杂疾病的重大挑战。
中南大学梁德生教授团队是濒湖生物的合作研发方,在肿瘤和遗传病的非病毒靶向基因修饰干细胞治疗领域已有20余年的研究和技术积累,在目前病毒载体介导的基因治疗大背景下,独辟更安全高效的靶向细胞基因治疗技术策略,取得了一系列自主创新成果。
濒湖生物是一家创新型生物技术公司,业务主要为研发、生产和提供针对肿瘤和重要遗传疾病的治疗手段和药物,目标实现癌症和重大疾病防治的革命性突破,造福人类健康。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。