
# 热门搜索 #
面对天价治疗费、工业化难题,摆在基因治疗企业面前已有多条解决途径
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持CAR-T、CRISPR/Cas9、AAV,这些英文缩写在十年前对于医疗健康领域的从业者们都还非常陌生,而如今已经成了大家会议圆桌上的讨论中心。这些英文缩写所指的同一个方向,就是基因治疗。基因治疗在CRISPR/Cas9基因编辑系统出现后备受推崇,又在CAR-T成功上市后迎来一番热潮。
但是在盛筵之后,当我们重新审视这个行业,会发现在基因治疗技术快速前进的同时,还暴露出了诸多的问题。虽然基因治疗的技术正在逐步成熟,但是从科研向产品转化的工业化流程和最终的产品定价问题仍然困扰着这个用弹射方式起步的新行业。
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,最终达到治疗目的。针对不同疾病的发病原理,可以选择基因编辑、过表达等不同的技术手段。而站在治疗前沿的就是基因编辑和过表达技术。
基因编辑在CRISPR/Cas9技术登场之后正式进军临床领域。比起锌指核酸酶和TALENS技术,CRISPR/Cas9技术在精准度、稳定性和简便性上都有较大的提升,并以CRISPR/Cas9为基础衍生出了很多技术门类,如单碱基编辑、腺嘌呤碱基编辑等。CRISPR/Cas9系统为人类实现基因组DNA的精准操纵提供了新的通路。虽然仍有小概率出现的脱靶概率,但是目前为止CRISPR/Cas9系统在基因编辑领域的应用前景还是一片光明。
另一种主要的基因治疗方向就是过表达手段。过表达的治疗思路其实很简单,既然患者的发病是由于缺乏某种蛋白或某种蛋白的功能失活,那么外源向细胞中转入表达该蛋白的基因不就可以根治了么。目前过表达基因治疗也是基因治疗药物中进展最快的一类,去年获FDA批准的基因治疗药物Luxturna就是应用了过表达基因治疗的方法。
除了以上两种之外,还有一类更加热门的基因治疗方法就是将细胞治疗与基因治疗相结合,从患者自体中提取细胞,在体外对细胞进行基因编辑后输送回患者体内以治疗疾病。近几年大热的CAR-T正是此类产品的关键成功案例。事实上以这种方式进行治疗的还有2016年在欧洲上市的Strimvelis。
提到基因治疗,就不得不提一下基因治疗最终进入医疗场景中的关键载体,腺相关病毒(AAV)。AAV是一类腺伴随病毒,需要辅助病毒(通常为腺病毒)参与复制。其基因组DNA一般小于5kb,宿主细胞范围广,免疫原性低。因此AAV在被改造后,成为了将基因治疗原件导入细胞中的优秀载体。
除了AAV之外,其实还有逆转录病毒、腺病毒等其他类型的病毒载体。但是AAV载体有一项关键的独特优势,就是AAV病毒的基因组在进入细胞之后不会整合到细胞的基因组上,而是会以环状DNA的形式存在于细胞核当中。如果基因要通过整合进入基因组的方式留在细胞当中,在整合进基因组的过程中,由于插入位点的不确定性,可能会影响基因组部分基因的表达,引起不可预测的风险因素。AAV的这一特质意味着AAV载体在应用于基因治疗的过程中是完全安全的,不会对细胞正常的生理过程造成影响。由于AAV送入细胞核的环状DNA无法随着细胞分裂进行复制,所以在使用AAV的治疗方案中通常以静息细胞为目标,如肌肉细胞、肝细胞和神经细胞等。
目前为止除了两款大名鼎鼎的CAR-T产品之外,共有三款基因治疗药物或疗法获批。最先获批的是脂蛋白脂肪酶缺乏症治疗药物Glybera;然后是重症联合免疫缺陷疗法Strimvelis;第三种就是2017年获批的先天性黑蒙药物Luxturna。
图:Glybera
Glybera是第一个在西方国家被批准上市的基因治疗药物。Glybera由UniQure研发,用于治疗脂蛋白脂肪酶缺乏症。顾名思义,脂蛋白脂肪酶缺乏症由于患者血液中脂蛋白脂肪酶缺乏或失活引起。Glybera利用AAV将产生脂蛋白脂肪酶的基因导入骨骼肌细胞中,使其向血液中分泌脂蛋白脂肪酶,以达到治疗疾病的效果,也就是过表达治疗方式。
Glybera在2012年获欧盟批准,2014年正式上市。除了最先获批,Glybera还是当时最贵的药物,111万欧元的治疗价格让所有药物都望尘莫及。但是这样的高价也不能全怪UniQure。Glybera的适应症脂蛋白酶缺乏症的发病率仅为百万分之一,只有这样的价格才有可能让UniQure从有限的患者头上收回药物的研发成本。
但是患者看起来并不买账。在Glybera销售的4年时间中只有一名患者接受了Glybera的治疗,并且还是在保险公司大额报销的情况下。2017年4月,在即将迎来上市期限之际,UniQure宣布不再延期。于是第一款基因治疗药物就这样黯然退出了舞台。如今人们仍然津津乐道的,并不是Glybera取得的成就,而是百万美元的高价,和四年一人的尴尬。
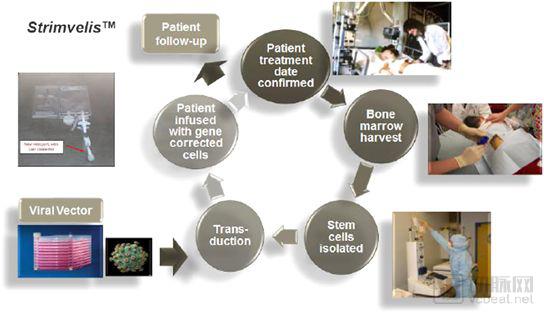
图:Strimvelis
在Glybera之后,2016年5月,欧盟批准了第二款基因治疗药物Strimvelis。Strimvelis由制药巨头葛兰素史克(GSK)研发,用于治疗重症联合免疫缺陷,治疗原理与CAR-T类似。重症联合免疫缺陷由腺苷脱氨酶突变导致的T淋巴细胞发育异常导致。在Strimvelis治疗过程中,患者的造血干细胞被分离出来,在体外进行基因修饰,导入了正常的腺苷脱氨酶基因。这些经处理的造血干细胞被重新回输到患者体内,产生正常的T细胞,重建患者的免疫系统。
Strimvelis售价59.4万欧元,虽然只是Glybera一半的价格,但是也可以称得上是天价了。然而欧洲每年只有不到20个患者,即使所有的患者都接受Strimvelis的治疗,每年的销售额也只有1000万欧元。更何况Strimvelis的销售情况并不如意,在获批近一年之后才收到了第一例患者。
第一款CAR-T产品Kymriah于2017年8月获批,诺华抢先一步,拔得头筹。紧接着在2017年10月,吉利德收购的Yescarta也获批上市。在两款CAR-T产品获批之后不久,美国FDA就批准了又一款基因治疗产品。2017年12月,美国FDA批准了Spark Therapeutics的Luxturna用于治疗先天性黑蒙。Luxturna的治疗方式于Glybera类似,利用AAV将正常的RPE65基因转入视网膜细胞中以治疗疾病。
图:Luxturna
Luxturna的定价在Glybera的基础上有一定的降低,但是价格仍然高达85万美元。并且眼科基因治疗药物有着独特的工业化优势。眼科药物的目标细胞数量少,范围也比较小,并不需要对病毒进行大规模的生产,可能只要中试规模的生产就足以满足眼科用药的需求。并且Luxturna并不能治疗所有的先天性黑蒙,只有RPE65突变引起的先天性黑蒙才能被治愈。
“贵”可能是打在基因治疗身上的一个抹不掉的标签。目前为止在西方国家获批上市的五款药物或治疗方案,最便宜的Yescarta也要37.3万美元,折合成人民币就是250万元。据国际货币基金组织(IMF)估计,2018年美国人均GDP在6.25万美元。37.3万美元即使对于美国的中产阶级而言,都是一笔难以承受的开销。虽然医疗保险会覆盖掉大部分的治疗开销,但是过高的价格对于保险的压力也可能会造成保险支付困难。
摆在基因治疗面前的,是价格与患者需求之间的不平衡。基因治疗的适应症往往以罕见病为主,这些疾病的患病人群本来就小,而基因治疗的研发过程却同样需要大量的资金投入。Spark Therapeutics在研发Glybera的过程中花费了大约2亿美元。产品的定价要能够在专利到期之前覆盖成本,并为公司带来一定的收入。而在目标人群小的情况下,每个患者需要分摊的研发成本就要相应的增高。但是定价过高,又会打击患者的治疗意愿。因此在基因治疗的定价方面,很难与患者的需求达到适当的平衡。
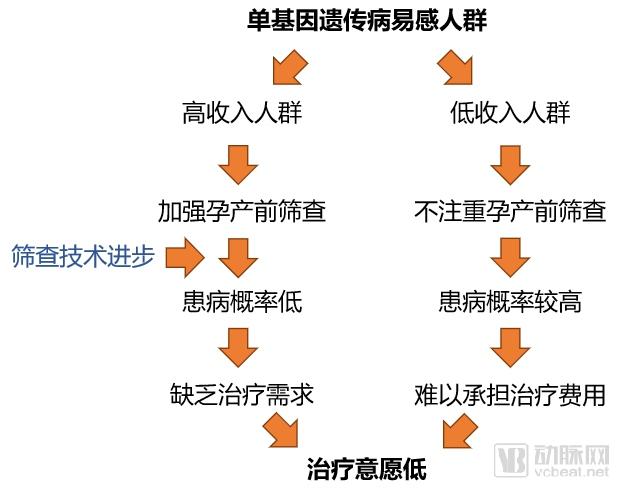
图:单基因遗传病治疗产品定价困境
对于单基因遗传病,筛查手段的进步为基因治疗的定价带来了更进一步的难题。由于孕产前筛查技术的进步,多数有能力进行充分孕产前筛查的人群会在婴儿出生前进行完备的筛查,以规避遗传病风险。而最终患病的新生儿,往往来自较低收入的家庭。于是单基因遗传病基因治疗会陷入一种治的起的人没需求,而有需求的人治不起的两难境地。
保险看似是解决这一问题的优秀答案。Glybera的唯一一例患者和Strimvelis的第一例患者都是由保险支付了大多数的费用。但是目前在CAR-T治疗的报销上,保险支付就出现了问题。CAR-T在美国上市已经有一年半,然而至今还没有确定保险报销细节。在CAR-T疗法的临床应用过程中,除了治疗本身的费用,还有很多其他的费用支出,包括人员的培训、相应的仪器设备和医院盈利额等多个方面。
保险承诺了为患者支付费用,但是医院却迟迟收不到款项。于是中间产生的损失就只能由医院来承担。据两家获得FDA批准CAR-T疗法上市的药企(吉利德和诺华)统计,目前美国约有130家医疗机构能够向患者提供CAR-T疗法,但只有累计不到2,000名患者接受了这种治疗。每家医院每年承担十名患者的损失可能暂时还在可控的范围内。但是长此以往,并不利于行业的健康发展。
虽然保险支付现在在CAR-T上运作不佳,但是医疗保险仍然是解决支付问题最有效的方案之一。只有保险有能力为多数患者支付高昂的治疗费用。受惠于基因治疗随着行业的发展,相应的保险细则会更加完善,保险处理相关患者的效率也会大幅增高。
在保险支付不力的当下,企业开始对其他的支付方式妥协。Luxturna吸取了Glybera的教训,允许多种支付方式并存。首先Luxturna承诺按疗效付费,如果药物没能达到短期(30-90天)和长期(30个月)的治疗效果,会退还患者部分治疗费用。同时Luxturna允许患者以分期付款的方式进行治疗,这极大的降低了患者的治疗门槛。在2018年前三个季度,Luxturna为Spark Therapeutics带来了1560万美元的收入,并且在几个季度中持续增长。虽然这样的支付方式可能会影响企业的资金回收,但是比起销售停滞,还是先将产品卖出去比较重要。
基因治疗行业的另一关键点在于工业化问题。技术上的成熟只是在科研领域,从科研到临床之间的跨度是基因治疗行业亟待跨越的鸿沟。Aquilo Capital Management负责人Patrick Rivers在再生医学联盟的相关论坛上表示,在评估被投公司时,最关键的问题就在于他们的制造工艺,尤其是依赖于病毒供应的基因治疗开发商。

图:从科研到工业化生产的工艺差距
以AAV的包装为例,在小鼠实验中使用的AAV病毒量,培养皿培养贴壁细胞就可以满足。再进一步,比如应用于灵长类动物实验或者1-2名患者的临床试验,可能使用较大的培养瓶或者细胞工厂也可以勉强够用。这样的产品供应方式可以应对小量的实验要求,但是成本较高,而且每次实验之间的稳定性没有保证。
如果最终成药,走向大批量生产,只用实验室中的细胞培养手段是不够用的。培养装置可能要换成更大的细胞培养罐,用的细胞可能也要从贴壁细胞换成悬浮细胞。在这样的规模扩大过程中,整个细胞的培养体系发生了极大的变化,导致在实验室中使用的已成型的小试、中试工艺不能直接应用于工业化生产当中。于是工业化生产又要重新摸索所有的条件,从细胞培养到转染手段再到病毒浓缩。除了培养方式变化,还要考虑临床标准的建立。如何保证从科研转化到临床的产品能够符合临床标准,以及自不同批次的产品之间保持较好的稳定性,这些都是基因治疗工业化生产中要解决的问题。
基因治疗虽然已经陆续有产品上市,但是整个行业缺乏明确共识,产品的工业化模式也属于各公司内的商业机密,甚至是行业内竞争的关键筹码。已经上市的产品对于产品流程的细节也保持保密状态。不清楚的人在独自摸索,有些了解的人闭口不谈,这让基因治疗行业的工业化进程难上加难。Aisling Capital的创始人Dennis Purcell曾表示,基因治疗行业的临床试验相当透明。但是当他们在对制造业进行尽调时却困难重重。
首先是选择自建。最近就有很多家基因治疗的头部企业开始进行工业化厂房的修建工作。Bluebird bio北卡罗来纳州的新基因治疗工厂在上月剪彩投用;诺华旗下的AveXis 2019年2月宣布将扩建北卡罗来纳州的工厂,4月又宣布将收购科罗拉多州的一家制造工厂,用于生产其计划推出的Zolgensma(脊髓性肌萎缩的基因疗法)。在整个行业缺乏第三方代工厂商的情况下,有很多企业选择了自建GMP车间,同时这也是多数初创企业未来的发展方向。
第二种选项就是期待着自己的公司或者产品被大药企收购。事实上,辉瑞、诺华、罗氏等大药企们也都在积极的向基因治疗行业布局。CAR-T的两家头部企业Juno Therapeutics和Kite Pharma就分别被新基制药和吉利德收入囊中。大药企在产品化方面更有经验,而且有充足的资金流用于维持项目进度和工业化研发。
除了以上两种,第三方代工会是这个问题的绝佳解决方案。如果基因治疗将在未来的一段时间内成为医疗健康行业的关注重心,那么为基因治疗服务的CMO行业一定也会随之增长。虽然缺乏标准化流程让CMO行业的起步步履维艰,但是更大的挑战同时也带来了更大的机遇。在现在这个基因治疗工业化问题凸显的时段,正是相应CMO行业面前的机遇。如果能够将基因治疗产品的工业化问题解决,那么这样的企业必然会迅速成长为前沿行业中的独角兽。
在再生医学联盟的相关论坛上,Roivant Science的首席财务官Matthew Gline对此表示了积极的态度。他认为解决制造业的需求为创业公司创造了一个绝佳的机会。这样的企业能让更多的基因治疗公司免于工业化问题的困扰,并且最终有能力成长到Illumina之于基因检测行业的地位。
人们都希望可以有用得上,用得起,治得好的药,而现在的基因治疗还远没能达到这样的标准。事实上这样的情况不仅仅发生在基因治疗行业,只是这个高速发展的新兴行业放大了问题带来的影响。在靶向药物、基因检测、液体活检等行业中,其实都存在着类似的问题。技术进步最终会覆盖这些问题,让这些当下的前沿技术变得触手可及。但是问题在于究竟要多长时间,这样的技术才能从初生变得成熟。
如今困在定价与工业化问题上的是基因治疗行业。当基因治疗行业成功破局时,是否又会有其他行业困在同一个问题上?医疗健康领域能否吸取基因治疗行业的经验教训,让新行业的发展不再受制于这些老生常谈的问题?问题终将被解决,我们只是希望那一天来的更早一些。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。