
# 热门搜索 #
中国医疗器械分类与审批流程,45天内完成全部审批
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
医疗器械按照风险程度由低到高,管理类别依次分为第一类、第二类和第三类。
一类:通过常规管理足以保证其安全性、有效性的医疗器械。
例如:基础外科用刀(手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲刀、剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲刀、解剖刀等)。
二类:对其安全性、有效性应当加以控制的医疗器械。
例如:(a)普通诊察器械类(6820):体温计、血压计;( b)物理治疗及康复设备类(6826):磁疗器具; (c)临床检验分析仪器类(6840):家庭用血糖分析仪及试纸; (d)手术室、急救室、诊疗室设备及器具类(6854):医用小型制氧机 手提式氧气发生器; (e)医用卫生材料及敷料类(6864):匡用脱脂棉、医用脱脂纱布; (f)医用高分子材料及制品类(6866):避孕套、避孕帽等。
三类:植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。
例如:(A)、一次性使用无菌医疗器械 1、一次性使用无菌注射器;2、一次性使用输液器; 3、一次性使用输血器; 4、一次性使用麻醉穿刺包; 5、一次性使用静脉输液针; 6、一次性使用无菌注射针; 7、一次性使用塑料血袋; 8、一次性使用采血器; 9、一次性使用滴定管式输液器。(B)、骨科植入物医疗器械 1、外科植入物关节假体;(一次性使用无菌医疗器械、助听器、隐形眼镜及护理用液、体外诊断试剂、6846植入材料和人工器官、6877介入器材除外)等。
一个医疗器械的审批倒底是划到哪一类里边也不是固定不变的,是由它的安全性决定的,国家食品药品监督管理总局(CFDA)有权改变它的分类,比如口罩在一般时期都分为一类,但在非典时期就被划到了二类。
第一类医疗器械产品首次备案程序
开办第一类医疗器械生产企业的,应当向所在地设区的市级食品药品监督管理部门办理第一类医疗器械生产备案,食品药品监督管理部门应当当场对企业提交资料的完整性进行核对,符合规定条件的予以备案,发给第一类医疗器械生产备案凭证。
备案一类医疗器械所需材料清单:
(一)营业执照、组织机构代码证复印件;
(二)提交备案企业持有的所生产医疗器械的备案凭证复印件;
(三)法定代表人、企业负责人身份证明复印件;
(四)生产、质量和技术负责人的身份、学历、职称证明复印件;
(五)生产管理、质量检验岗位从业人员学历、职称一览表;
(六)生产场地的证明文件,有特殊生产环境要求的还应当提交设施、环境的证明文件复印件;
(七)主要生产设备和检验设备目录;
(八)质量手册和程序文件;
(九)工艺流程图;
(十)经办人授权证明;
(十一)其他证明资料。
第二、三类医疗器械产品首次注册审批程序
开办第二类、第三类医疗器械生产企业的,应当向所在地省、自治区、直辖市食品药品监督管理部门申请生产许可。
申请二类医疗器械所需材料清单:
除了准备备案一类医疗器械所需材料清单材料外(第二条除外),增加申请企业持有的所生产医疗器械的注册证及产品技术要求复印件。
申请流程
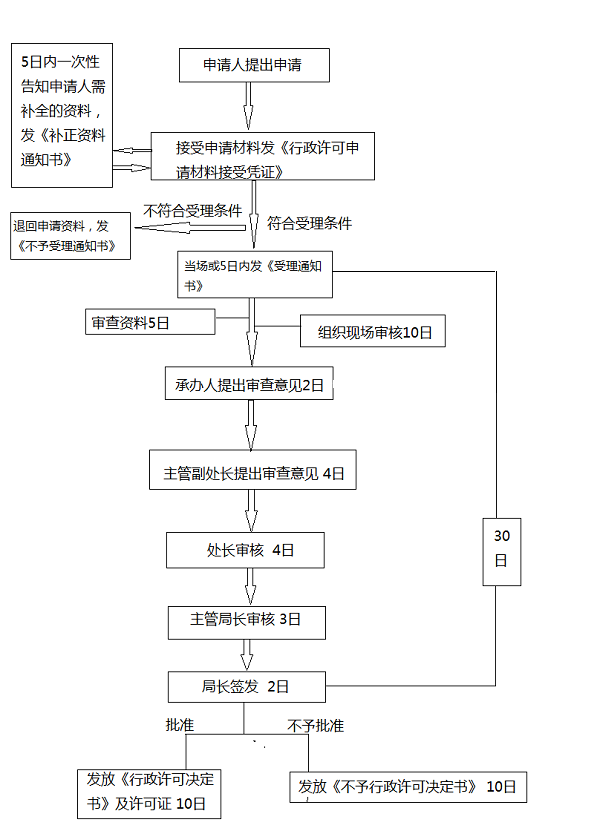
第二、三类医疗器械首次注册审批所需时间为45天。《医疗器械生产许可证》有效期为5年,《医疗器械生产许可证》有效期届满延续的,医疗器械生产企业应当自有效期届满6个月前,向原发证部门提出《医疗器械生产许可证》延续申请。然后按照首次申请流程重新审查。
另外,在申请二、三类医疗器械的时候,应当提交临床试验资料。在中国境内进行临床试验的医疗器械,其临床试验材料中应当包括临床实验合同、临床试验方案、临床试验报告。对于市场上尚未出现的第三类植入体内或借用中医理论制成的医疗器械,临床试验方案应当向医疗器械技术评审机构备案。
免责声明:本文主要以科普为主,凡是申请医疗器械许可证的企业,请前往国家食品药品监督管理总局官网查看2014年7月30日颁发的《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)。友情提醒2004年颁发的《医疗器械生产监督管理办法》已经废止,不要看错了。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。