
# 热门搜索 #
里程碑 ! 药品审评中心受理国内首个CAR-T疗法临床申请
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持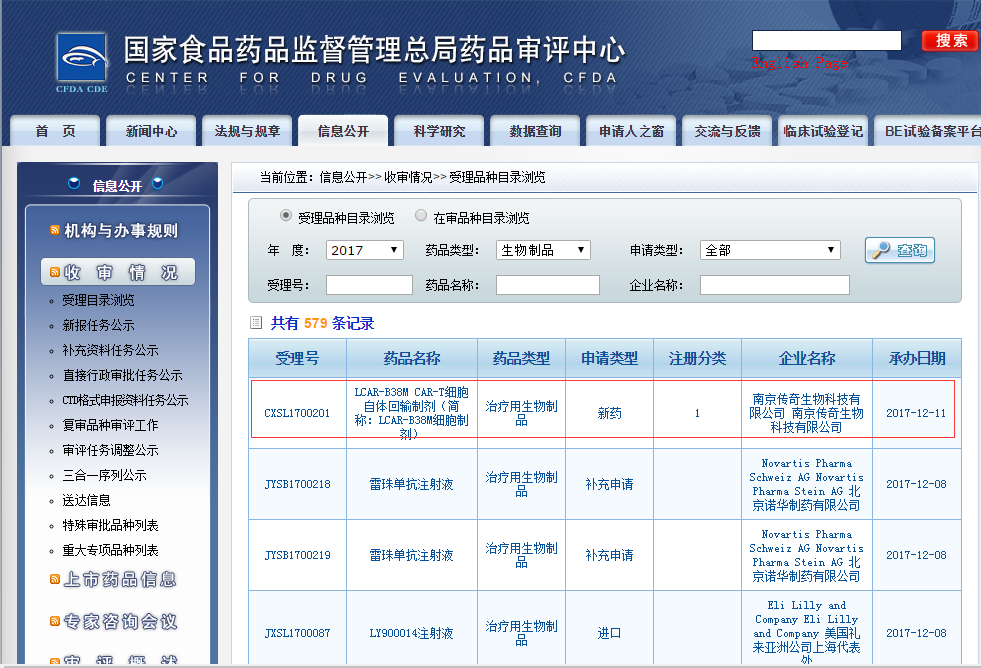
2017年12月11日,南京传奇生物科技有限公司(以下简称南京传奇)提交的CAR-T疗法中国临床申请(CXSL1700201)获得CDE(药品审评中心)正式承办受理。这是国内将CAR-T项目以药物进行监管后,首个提交的CAR-T项目临床申请。
南京传奇成立2014年,是金斯瑞旗下的全资子公司。公司专注于研究和发展免疫治疗中嵌合抗原受体细胞技术。这家公司向来低调,直到2017年6月5日,公司在ASCO上发布了靶向BCMA的CAR-T疗法的临床数据,其CAR-T疗法在多发性骨髓瘤的治疗上展现的优异成绩,使其迅速成为焦点。
LCAR-B38M是南京传奇研发的一款靶向BCMA的CAR-T疗法。根据数据显示,在一项35例复发性或耐药性多发性骨髓瘤患者参与的临床试验中,该疗法的客观缓解率达到100%。在最早接受治疗的19例患者中,南京传奇对其观察随访4-14个月以上。其中14名患者持续达到严格完全反应诊断标准,5位出现部分缓解。
南京传奇的首席科学官Xiaohu (Frank) Fan博士透露,该公司计划在中国招募100名患者参与临床试验。
南京传奇此次是按照生物制品1类(未在国内外上市销售的生物制品)提交的注册申请,药品名称为“LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)”。
CAR-T疗法在国内的监管思路进一步清晰,将作为药品进行管理,须先获得CFDA的临床批件,待完成临床试验后再申报上市。
尽管从“文件受理”到“文件批复”还有一定的距离,从临床试验开始到产品上市更是长路漫漫。但CDE对材料的受理意味着中国CAR-T疗法正式迈出了第一步,具有里程碑意义,同时也将为国内数百家CAR-T治疗公司带来莫大的鼓励。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。