
# 热门搜索 #
Spark Therapeutics:全球基因治疗的先行者
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
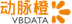 提供支持
提供支持文/格格
假如一个人的基因能被改变,而没有或很少有副作用,那么人类未来的命运会不会有新转机? 听起来是不是很科幻,其实一点也不,看下这家已被美国FDA批准了的基因治疗公司Spark Therapeutics。“We don’t follow footsteps. We create the path.” 愿他们真能点亮(Spark)基因治疗的未来。
主要公司:Spark Therapeutics(NASDAQ:ONCE)
包括公司:Shire (NASDAQ:SHPG)
Sangamo (NASDAQ:SGMO)
Nightstar Therapeutics(NASDAQ: NITE)
uniQure N.V.(NASDAQ: QURE)
文章摘要
1、Spark Therapeutics有全球基因治疗中首个获批的药物,在这领域中是先行者。公司连续2年(2016,2017)被评为MIT Technology Review’s list 50的Top10,同时被评为2018年Bloomberg Businessweek’s “50 Companies to Watch”之一;
2、2017年12月19日首款一次性基因治疗RPE65等位基因突变的视网膜萎缩症获美国FDA批准上市,是基因治疗领域的一个分水岭事件;
3、Philadelphia有48000立方英尺的全球最先进的cGMP工厂,这也是基因治疗领域首个及唯一被美国FDA批准的工厂;
4、欧洲及除美国的全球的销售与诺华Novartis (NVS)签订协议,这对创新性科技公司来说是非常正面的,为未来稳定的收入及长远发展打下基础。截止2017年12月,公司尚有现金$540.2M,加上一月份与诺华合作的首付款$105M,公司目前现金充沛。Derisk后,公司是2018年首选的稳健型纳斯达克基因治疗公司。

Spark Therapeutics是一家基因治疗公司,研发针对于遗传性视网膜病变(inherited retinal diseases IRDs)、神经退行性病变、通过改变肝脏基因有可能得到治愈的遗传性疾病等的药物,这种基因治疗通常是一次性给药就可以治愈疾病。
公司2013年成立,2015年纳斯达克上市,2017年12月19日首款一次性基因治疗RPE65等位基因突变的视网膜萎缩症药物获美国FDA批准上市,是基因治疗领域的一个分水岭事件。公司目前市值$30亿(2018.4.20收市后)。
公司最早的技术是来自于Children’s Hospital of Philadelphia (CHOP),科学家团队在基因治疗领域已有20多年的经验了,为之后腺病毒相关载体(adeno-associated viral AAV)平台的研发,工厂的建立,AAV在骨骼、肌肉、肝脏中的作用打下了基础。
Spark Therapeutics有320多名领域内专业的员工,在Philadelphia有48000立方英尺的全球最先进的cGMP工厂,这也是基因治疗领域首个及唯一被美国FDA批准的工厂,内部生产AAV载体,有6条线路来满足超过12个临床试验中心的临床试验进行,最后组装成药物来满足临床需要。
公司连续2年(2016,2017)被评为MIT Technology Review’s list 50的前10名,同时被评为2018年Bloomberg Businessweek’s “50 Companies to Watch”之一。
管线进展及分析
1. LUXTURNA(Voretigene neparvovec): biallelic RPE65-mediated IRD
RPE65 突变相关的遗传性视网膜疾病(Inherited Retinal Disease IRD)流行病、市场及定价
遗传性视网膜疾病是一种罕见的盲病,大约由超过220种不同的基因引起,常见于儿童及年轻人,RPE65等位基因突变是其中一种,患者最终都会完全失明,他们会经历夜盲,无意识的眼球震颤,疾病进展时,病人会先失去外周(peripheral)的视野,发展为中间隧道样(tunnel)视野,最终,中间的视野也全是消失,发展成完全失明。
目前没有其他任何获批的药物针对RPE56突变引起的IRD。根据Spark估计的流行病数据,美国、欧洲及环太平洋地区由约6000名RPE65突变的患者,在美国大约有1000-2000名由于RPE65突变致盲的患者,每年在美国新增患者数约10-20名。
上市后,LUXTURNA的定价在双眼治疗的费用为$85万/次。Spark表示,如果LUXTURNA不起作用,将退还患者部分费用。
2017年12月19日LUXTURNA正式被美国FDA批准上市,之前获得FDA的Priority Review、orphan drug designation和breakthrough therapy designation。
批准后,公司还获得一儿童罕见病优先审核票,这个目前市场价在1-2亿美元。在2018年1季度,可以看到此药在美国的销售情况了。欧洲的NDA在2017年7月31日提交。
此药之前已获得欧洲orphan drug designation,这在欧洲有多10年的市场独占权。欧洲及全球除美国市场,已经license给诺华,公司收到$105 million首付款,$65million的milestone费,未来还有约25%的royalty费用。
LUXTURNA3期临床试验结果
临床试验的结果发表在最著名期刊The Lancet上,有效性是基于1年MLMT(multi-luminance mobility test)评分的改变而确定的。考虑到视网膜的生长,患者年龄小于12个月的不能使用此药。3期临床结果显示,有效性:在21例用药和10例对照组中,用药后1年,中位双边MLMT评分(P=0.001)和中位第一只眼治疗的MLMT评分(P=0.003)完全有差异。在交叉使用LUXTURNA后,对照组的患者对治疗有同样的效果。安全性:副反应包括结膜充血(22%), 白内障(20%),眼内压增高(15%),视网膜撕裂 (10%),眼炎(5%),眼痛(5%)等。
2. SPK-7001: Choroideremia(CHM)
CHM是一种X染色体相关的IRDs,在青少年中表现为夜盲症和视野减少,并进行性的视野缩窄,CHM的特点是CHM基因的缺失或者突变,导致了Rab escort 蛋白1的缺失,公司估计美国及欧洲5国有大约12500名男性患有此病。
该管线为临床1/2期试验,已招募10名患者,分成2种剂量组。最近公司还招幕5名相对早期的患者。已显示的数据表明,SPK-7001耐受性较好,未见药物相关性副反应或严重不良反应SAEs。
截止2017年3月29日,有5例已有1年的随访,4例有18个月的随访,1例有接近2年的随访,中期数据显示10个病人中4个病人显示出注射药物和对照眼睛的视力差异来。在安全性上,这些患者将被随访15年。SPK-7001已获得美国及欧洲的Orphan Drug Designation。
RPE65及CHM是IRDs220多种基因突变中的2种,ONCE还在其他IRDs上进行相应的临床前研究,如Leber hereditary optic neuropathy等。
3. SPK-9001: Hemophilia B
血友病B是缺乏功能性FIX导致的凝血功能障碍,这种凝血因子是在肝脏细胞中生产的,肝脏细胞编辑FIX蛋白的基因发生突变,导致了此病的发生。此病会有反复的危及生命的自发性出血,根据2016年World Federation of Hemophilia Annual Global Survey调查显示,全球大约有30000名患者。
严重血友病B定义为血液中FIX的含量为正常的1%以下。这类患者经常经历自发性出血,导致关节及肌肉内出血。中等血友病B定义为血液中FIX的含量为正常的1-5%之间。目前的治疗主要是预防及FIX因子的静脉输注。
2014年公司和辉瑞Pfizer(NYSE:PFE)达成协议,公司完成SPK-9001的临床1/2期试验后,交给辉瑞完成后续的研发、申请上市、商业化等。2016年获得FDA的breakthrough designation。
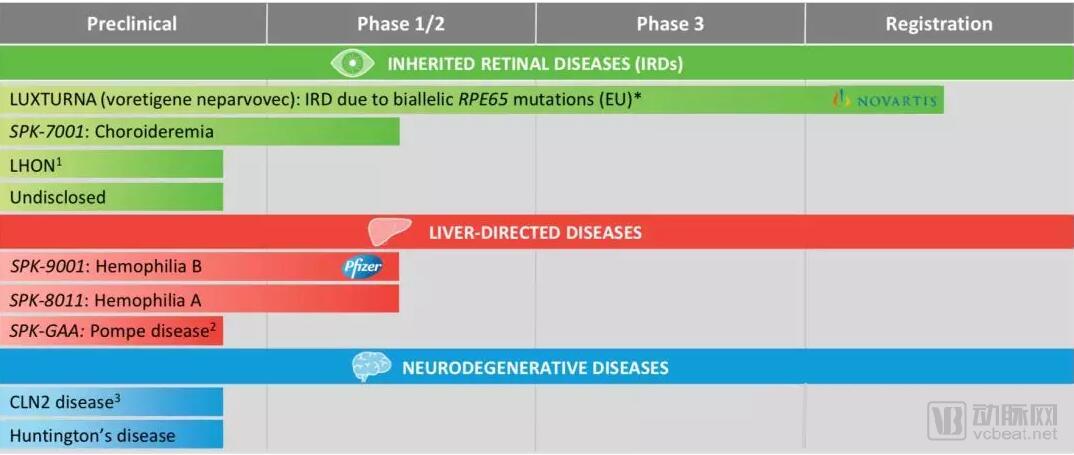
临床试验结果:有效性:截止2017年11月29日,第一批11名患者,接受5 x 1011 vector genomes/Kg体重剂量。所有的11名患者均停止了输注IX因子,血液中的IX维持在稳定状态,基于入组前的数据,患者的总体年化出血率(annualized bleeding rate ABR)减少97%,总体年化输血率(annualized infusion rate AIR)减少99%。
血液中的IX因子活性在用药后12个星期后维持在正常的36%(range as of the data cutoff: 15-78%)。公司还将募集4名患者参加1/2期临床试验,他们将会使用SPK-9001的加强后处理,来观察新的加强后处理的药物与SPK-9001的相容性。
安全性:没有严重不良事件,血栓事件,或者IX因子抑制剂(抗体产生)产生,2名患者出现无症状的短暂的肝酶升高,通过口服皮质醇类激素,解决了此问题。其中一名有严重关节疾病的患者,因怀疑关节出血而输注凝血因子。
4. SPK-8011: Hemophilia A
血友病A是由于肝脏细胞基因突变,VIII产生缺乏,导致反复的自发性出血,和血友病B一样,按照血液中凝血因子1%以下,定义为严重血友病A,1-5%定义为中等程度的学友病A,临床表现基本同血友病B。根据2016年World Federation of Hemophilia Annual Global Survey调查显示,全球大约有150000名患者。2018年2月,获FDA的breakthrough designation。公司保留全球商业化权利。
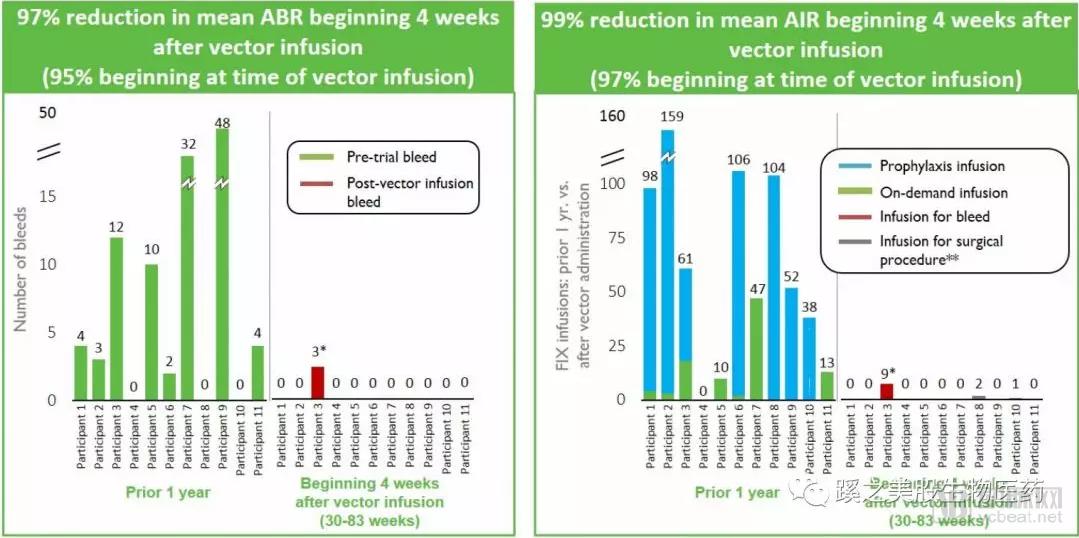
临床试验结果:有效性:截止2017年12月6日,第一批4名患者,接受5 x 1011 或者5 x 1012 vector genomes/Kg体重剂量。患者的总体年化出血率(annualized bleeding rate ABR)减少100%,总体年化输血率(annualized infusion rate AIR)减少98%。安全性:没有严重不良事件,血栓事件,或者VIII因子抑制剂产生。
点评:血友病A市场巨大,竞争的公司有Shire (NASDAQ:SHPG) and Sangamo (NASDAQ:SGMO)等 ,公司这个管线的病人数量少,而且12周后的血液中VIII因子变化范围大,在剂量的探索上可能还需要走一段路,有人认为公司针对这个指征的药物就是无效的,个人认为这种可能很小。竞争者BMRN的数据出来要比这个好不少,所以后期还需密切观察。
5. CNS-directed gene therapies
神经退行性变的两个疾病Batten disease和Huntington's disease,公司主要研发针对TPP1 缺乏的病人来治疗这两种疾病。目前管线都在临床前试验。两个管线都获得了孤儿药申请。
综上所述,Spark Therapeutics有全球基因治疗中首个获批的药物,在这领域中是先行者,在Philadelphia有全球最先进的cGMP工厂,这也是基因治疗领域首个及唯一被美国FDA批准的工厂。
公司连续2年(2016,2017)被评为MIT Technology Review’s list 50的前10名,同时被评为2018年Bloomberg Businessweek’s “50 Companies to Watch”之一。
欧洲及除美国的全球的销售与诺华Novartis (NVS)签订协议,这对创新性科技公司来说是非常正面的合作,为未来稳定的收入及长远发展打下基础。
目前公司现金充沛,风险较小,市值$30亿,是2018年首选的稳健型纳斯达克基因治疗公司。
市场竞争者
血友病A市场巨大,竞争的公司有Shire (NASDAQ:SHPG) and Sangamo (NASDAQ:SGMO)等;
Choroideremia领域的竞争者是Nightstar Therapeutics(NASDAQ: NITE);
Hemophilia B竞争者是uniQure N.V.(NASDAQ: QURE);
Valuation(现金及估值)
截止2017年12月,公司尚有现金$540.2M,加上一月份与诺华的合作的首付款$105M,公司目前现金充沛。公司曾在2017年8月公开发行股票一次,当时募资共$380.4 million,承销商执行了所有的option,每股价格为$76.00 per share。
机构及管理层持仓情况
公司管理层的基本都是从Children’s Hospital of Philadelphia出来的,在CEO Jeff Marrazzo的带领下,4年内,公司共融资$1 billion,并建立320人的公司团队,而且还荣获了诸多奖项。非常的优秀!
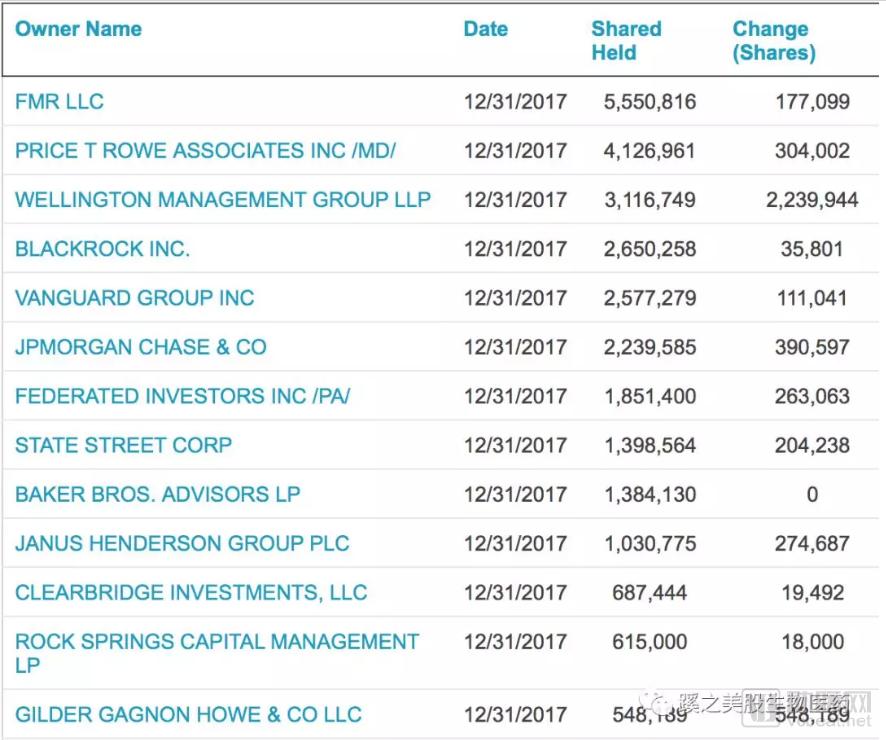
前十大股东包括了Baker Bro.等知名生物科技投资公司,同时还可以看到2017年4季度,机构增仓明显。
投资风险
该公司已获批的产品,市场销售推进不如预期,且安全性上还需要较长时间15年的观察, 期间有无其他不良反应,是不确定因素,竞争者的研发速度快,且结果更好,新的竞争者的加入。
本文作者:格格
美股生物医药研究员
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。