
# 热门搜索 #
蓝帆医疗BA9药物涂层球囊启动ISR临床试验,药球市场将重构
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持12月16日,蓝帆医疗旗下吉威医疗正式启动了优美莫司(Biolimus)释放冠状动脉球囊导管,即DCB-BA9产品的上市前临床试验,临床研究中心启动仪式在中国人民解放军总医院(301医院)举行,本次临床试验将会以陈韵岱教授所在的301医院为牵头单位,20家分中心同时进行临床试验研究,试验的目的为对比优美莫司释放冠状动脉球囊导管与紫杉醇释放冠状动脉球囊导管治疗冠状动脉支架内再狭窄(ISR)的安全性和有效性。12月,首例患者入组。

临床研究中心启动仪式,讲解者为陈韵岱教授
药物涂层球囊(DCB)是将抗内膜增生的药物以基质涂层等方式携带于球囊表面,当球囊扩张时,其携带的药物释放到病变部血管壁上,从而抑制内膜增生。因球囊充盈会堵塞血管,为了不造成心肌损失等并发症,需要在60秒之内完成药球治疗,这也是当下普遍选择吸收速率快,药物保留时间长的紫杉醇作为涂层药物首选的原因。然而紫杉醇细胞毒性的作用机制,以及在安全性和抗再狭窄上效果不佳,临床上需要一款更加优秀的涂层药物来替代。已在冠脉支架领域替代紫杉醇的西罗莫司(雷帕霉素)本该成为替代者,但由于西罗莫司存在亲脂性较低、药物组织吸收较慢,保留时间短,稳定性差等问题,成为阻碍其在药球领域替代紫杉醇的最大课题。
蓝帆医疗旗下柏盛国际的专利药物BA9完美解决了这些课题,BA9比其他莫司类药物具有更高的脂溶性,高效大约10倍;此外柏盛国际通过专利工艺,将BA9晶体化,实现了提高药物稳定性,及保留时间延长的效果;其还从载体聚合物入手,增强了药物吸收的能力。最后借助全新的药物涂层技术,保证涂层的均匀性和完整性,让BA9药物的吸收事半功倍。这些特性让BA9在药球领域,成为了莫司类药球的“扛把子”。
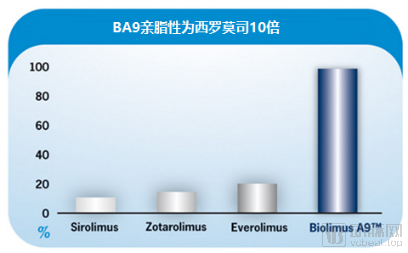
BA9脂溶性为西罗莫司的10倍
在科学技术部政务服务平台上的公示显示,此次试验的目的是“与紫杉醇释放冠脉球囊导管相比,评价优美莫司释放冠状动脉球囊导管治疗冠状动脉支架内再狭窄的安全性和有效性”。据蓝帆医疗相关负责人介绍,此次试验由陈韵岱教授领衔,并有诸多亮点,比如产品独有长度可以一次性解决弥漫病变;OCT亚组设计,可以更直观了解到支架内再狭窄形成原因,及术前、术后即刻、9个月时新生内膜情况;相关负责人还表示,基于2019年FDA三次发出紫杉醇的长期安全性可能导致死亡风险增加的预警,试验研究设计了长达3年的长期随访,这是目前全球唯一一个设立莫司类药物和紫杉醇3年随访来验证两种药物的长期安全性的试验,开创了药球临床研究之先河。首例患者已于12月正式进组,标志着蓝帆医疗旗下DCB-BA9正式进入了国内上市前的临床试验阶段。
吉威医疗DCB-BA9的临床试验项目,编号为2020BAL0609
早在2019年,DCB-BA9就开展了关于小血管病变(SVD)的临床试验,试验的目的为比较优美莫司(Biolimus) 释放冠状动脉球囊导管与普通球囊扩张导管在治疗冠状动脉小血管病变患者中的安全性和有效性。该试验由北部战区总医院的韩雅玲院士主持,周玉杰教授、傅国胜授联合研究,10家医院参与试验。据悉,试验近期将会举办中期研究者会,规划下一步工作。该项试验共有206例患者,最后一例患者于2020年4月末进组,所以预计最快2021年年中产品会以适用于SVD提交至NMPA。
自2009年,德国贝朗医疗发布第一款DCB至今,国际已经有十余种DCB产品,而国内DCB市场则由贝朗医疗、乐普医疗、申淇医疗、远大医药等企业占据,但市面上DCB的涂层药物均为紫杉醇,吉威医疗的DCB-BA9如若上市,将会成为国内市场上首款莫司类药球。
据“第二十二届全国介入心脏病学论坛”公布数据显示,我国2018年PCI手术数量为91.5万例,2009-2018年复合增长率为 16.7%,呈加速增长的势头。我们可以粗略推算药物涂层球囊市场空间,目前DCB主要适用于IRS,SVD,及CBL(分叉病变)三种适应症,在PCI手术中,IRS占比为5-10%,SVD占比20%左右,CBL占比15-20%,按照当前市场DCB均价2.5万/条测算,2020年国内药球市场空间超过100亿元。然而目前国内市场的DCB产品基本以治疗IRS为主,20亿元的SVD细分领域仅有远大医药一款DCB产品,但是依然使用紫杉醇药物涂层。我们可以预测,吉威医疗的DCB-BA9在完成了SVD和IRS的双重临床试验并且上市之日,就是药球市场重新洗牌之时。
此外,近年来心脏介入领域提出了“介入无植入”的创新理念,心脏支架领域也推出了BRS(生物可吸收支架),但是存在诸多问题。雅培在2017年宣布将销售近10年的BRS产品全面退市,与其在临床研究上发现BRS支架血栓等事件发生率增加有关,所以BRS的未来前景如何,还有待考量。然而DCB的治疗特性则正好契合这一理念。在解决了莫司类药物涂层球囊的阿喀琉斯之踵后,DCB-BA9有望成为“介入无植入”创新理念的代表性治疗方案之一。
未来该产品一旦在国内上市,借助蓝帆医疗在国内强大的销售网络,此款药球将会成为数十万相关适应症患者的福音。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。