
# 热门搜索 #
里程碑!CFDA通过首个CAR-T临床试验申请,南京传奇暂时领先 | 附其他CAR-T治疗第一梯队企业名单
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
2018年3月13日,香港金斯瑞生物科技(以下简称金斯瑞)发布公告称,其子公司南京传奇生物科技有限公司(以下简称南京传奇)正式收到了国家食品药品监督局(CFDA)授予的有关LCAR-B38MCAR-T用于自体回输的临床试验批件。
这是CFDA批准的首例CAR-T治疗临床试验申请,目前正处于等待制证过程中。
南京传奇成立于2014年,是南京金斯瑞的全资附属公司,专注于研究和发展CAR-T免疫治疗,近年来在多发性骨髓瘤的治疗上取得了多项突破。
LCAR-B38M CAR-T细胞制剂是基于南京传奇自有的嵌合抗原受体技术平台研发、靶向B细胞成熟抗原的双特异性嵌合抗原受体产品。LCAR-B38M 主要针对的适应症是多发性骨髓瘤,这是血液系统疾病中,发病率第二的常见性恶性肿瘤。
过去十年虽然上市了十多种相关新药,但依旧无法治愈,病人每年为维持生命总体花费需几十万元,且生理上极为痛苦。我国目前约有20万患者,每年新增至少6万例,大多患者年龄超过40岁,生存期仅3-5年。
据南京传奇在2017美国临床肿瘤学会年会披露的数据显示,在35名既往治疗后复发的多发性骨髓瘤患者中,有33人(94%)在接受试验性抗BCMA CAR-T细胞(LCAR-B38M)治疗后2个月获得临床缓解,显示明显的骨髓瘤临床缓解(完全反应或非常好的部分反应),客观缓解率达到100%。这在业界引起了极大震动,南京传奇也因此被美联社、路透社、华盛顿邮报等国际媒体誉为行业“黑马”。
据了解,南京传奇已经于2016年3月完成了一项关键技术的专利申请,其他有关嵌合抗原受体技术和产品的多项专利也找正在申请中,并力求在全球范围内获得专利保护。
2017年12月,公司在国内第一个提交了CAR-T治疗临床申请,并获得CDE正式承办受理。而此次,南京传奇又第一个获得了CFDA的临床试验批件。南京传奇在CAR-T治疗临床化这条路上一路领先。
但公司表示,由于LCAR-B38MCAR-T细胞自体回输制剂具有高技术含量及高风险的特点,从研发临床试验、再到投产的周期长、环节多。再加之受制于技术障碍、监管审核要求及政府政策,LCAR-B38MCAR-T细胞自体回输制剂的开发可能受多种因素影响。
因此,LCAR-B38MCAR-T细胞自体回输制剂于未来的竞争力存在不确定性。
CAR-T技术与基因合成技术一脉相承,是向下游的合成生物领域的延伸,也是公司在基因合成和基因编辑方面的延伸。未来,生命科学研究服务将是现金流的来源,生物酶领域将重点拓展,同时将继续在CAR-T治疗领域进行研发投入。
在2018年1月29日,CFDA的第26批拟纳入优先审评程序的药品注册申请公示中,共计39个药物入选,其中包括3个CAR-T疗法。
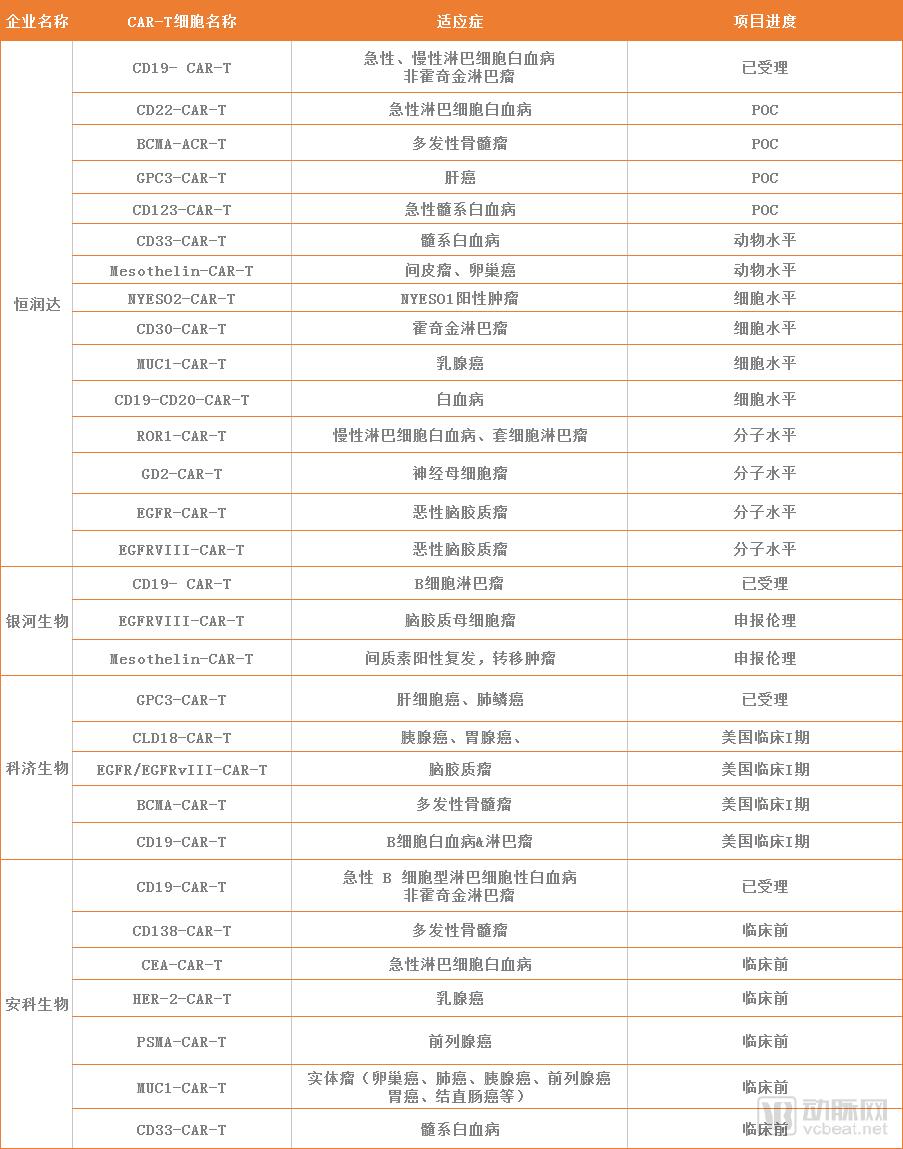
到目前为止,除南京传奇以外,另外还有4家企业的临床试验申请已进入受理状态:
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。